FluorCam叶绿素荧光成像技术应用案例 --- 大田与野外的光合作用研究
高等植物、藻类、地衣以及苔藓等生物对地球生态圈最大的贡献就在于其自身的光合作用,因此,对这些生物光合作用的研究就显得极其重要。而光合作用研究中一项必不可少的技术就是叶绿素荧光及成像分析技术。
众所周知,在实验室条件下与野外自然条件下,植物的生理状态可能会有很大的差异。而由于光合生理的特殊性(要求测量活体样品,样品离体后会有快速变化,且不能使用低温等常规保存手段),要想准确获得野外条件下的叶绿素荧光数据,就必须在野外进行原位测量,这在大田农作物和野外生理生态研究中尤为重要。
因此,这就需要有专门用于大田和野外的叶绿素荧光及成像仪器。FluorPen/AquaPen手持式叶绿素荧光仪轻便小巧,具备测量脉冲调制式荧光淬灭曲线和OJIP快速荧光动力学曲线的功能,同时配备多种探头适用于不同实验需求,但其不具备成像功能,难以全面反映植物光合生理的差异。FluorCam便携式叶绿素荧光成像仪是一款既可以在实验室工作,也可以很方便地进行大田野外测量的叶绿素荧光成像仪。它可以进行叶片、藻类、苔藓、地衣等各种不同样品的脉冲调制式叶绿素荧光成像分析。而如果想在野外大田进行整株植物乃至群体的光合生理,那么FluorCam移动式叶绿素荧光成像系统则是不二之选,其35×35cm的有效成像面积是目前野外脉冲调制式叶绿素荧光成像技术所能达到的最大成像面积。

左:FluorPen手持式叶绿素荧光仪;中:FluorCam便携式叶绿素荧光成像仪;右:FluorCam移动式叶绿素荧光成像系统
应用文献案例
1. 水稻稻瘟病、白叶枯病与干旱抗性的大田无损定量检测
水稻作为种植面积最广的作物,从而面临一系列的环境挑战。在热带和亚热带地区,水稻面临的最主要非生物胁迫就是干旱胁迫,同时如稻瘟病、白叶枯病等生物胁迫也会严重降低水稻的产量。全球气候变化模型则预测环境变化将会进一步加重这两类胁迫的发生频率与强度。因此,通过快速、无损、精确的植物表型光学分析技术进行这方面的研究就成为了极其迫切的任务。
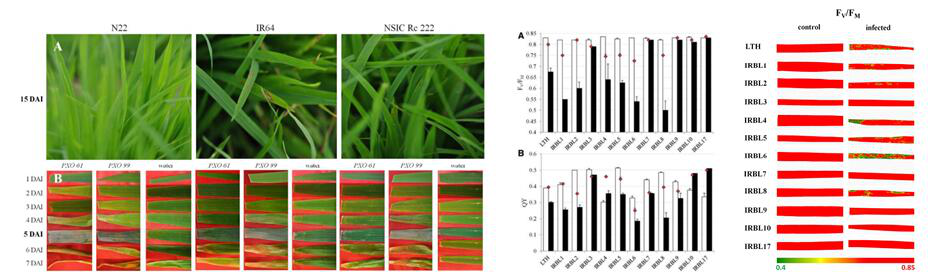
左:感染稻瘟病和白叶枯病的水稻; 中:叶绿素荧光Fv/Fm、QY数据; 右:感染稻瘟病水稻的Fv/Fm叶绿素荧光成像图
捷克科学院全球变化研究所联合美国堪萨斯州立大学、国际水稻研究所等单位开展了这方面的研究。研究者通过FluorPen手持式叶绿素荧光仪和FluorCam便携式荧光成像仪分别测量多种近等基因系水稻在不同胁迫下的叶绿素荧光参数。叶绿素荧光分析表明,光系统II最大光化学效率(或称最大量子产额)Fv/Fm、实际量子产额QY_Lss和稳态叶绿素荧光Ft_Lss都可以有效地分辨稻瘟病和白叶枯病。而在进行干旱胁迫检测时,QY_Lss则效果较好。
2. 南极生态研究
2006年,捷克在南极James Ross岛建设了Johann Gregor Mendel站。驻扎该站的捷克马萨里克大学与捷克科学院全球变化中心的科研人员从2007年就开展研究当地藻类和地衣对南极温度升高的响应,从而评估温室效应对南极生态系统的影响。当时他们使用了专门加强极地适应能力的AquaPen/FluorPen系列手持式叶绿素荧光测量仪来检测藻类和地衣的光合生理和生长状态。AquaPen/FluorPen既可以手动操作,也具备无人值守监测叶绿素荧光的功能,在南极的严酷环境下表现良好。
之后科研人员开始使用专门设计用于监测实验的Monitoring Pen叶绿素荧光自动监测仪。Monitoring Pen在理想情况下可自动连续工作2年,配有陆地增强版和水下增强版两个版本。

左:Johann Gregor Mendel站2007-2009年使用的AquaPen/FluorPen;右:近年开始使用的Monitoring Pen
在2019年最新的研究中,研究人员使用FluorPen手持式叶绿素荧光仪、FluorCam便携式叶绿素荧光成像仪、FluorCam开放式叶绿素荧光成像系统和SpectraPen手持式光谱仪来综合研究地衣Dermatocarpon polyphyllizum的温度、干旱、高光等极端环境因素的响应机制。
FluorPen具备OJIP快速叶绿素荧光动力学曲线分析测量能力,可以快速获取与植物/藻类光合生理与胁迫响应相关的二十余项参数。通过FluorCam便携式叶绿素荧光成像仪进行的叶绿素荧光淬灭动力学(也称为慢速叶绿素荧光动力学)分析,可以获取植物/藻类光合电子传递从启动到稳定的变化过程,计算反映光化学效率、光系统热耗散、光系统开放程度等一系列参数。
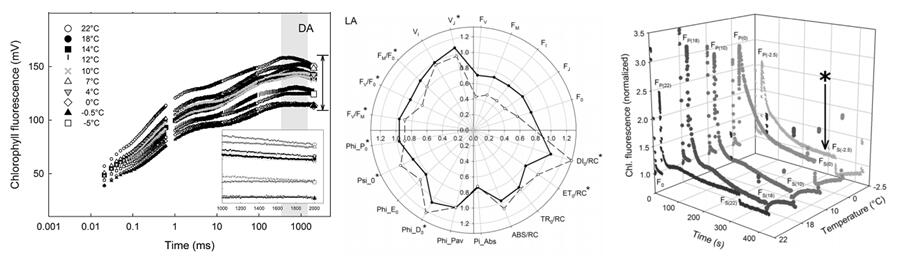
不同温度处理后的地衣叶绿素荧光分析:
左. OJIP快速叶绿素荧光动力学曲线;中. OJIP各项计算参数雷达图;右:叶绿素荧光淬灭动力学曲线
FluorCam叶绿素荧光成像系统除了测量上述叶绿素荧光曲线与参数,关键的优点是可以同时测量样品每个点的叶绿素荧光动力学变化,从而获得相应参数的成像图,用于反映样品整体状态与不同部位的差异,能够非常直观地展现不同处理之间的差异。
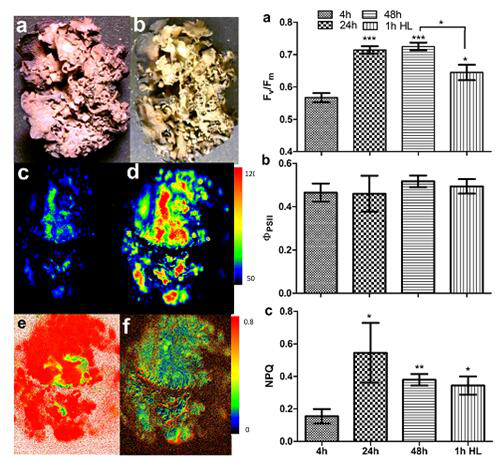
干燥、复水与高光处理的地衣叶绿素荧光成像分析:
左:a.干燥处理后彩色成像;b.复水48小时后彩色成像;c.最小荧光Fo:d.最大荧光Fm;e.最大光化学效率Fv/Fm;f.非光化学荧光淬灭系数NPQ;右:复水过程中荧光参数变化
同时,其他欧洲国家西班牙、意大利等的科学家也依托James Ross岛Johann Gregor Mendel站开展了大量南极生态研究。比如西班牙萨拉曼卡大学使用FluorCam便携式叶绿素荧光成像仪研究南极蓝藻Hassallia antarctica的干燥与渗透压胁迫对其光合能力的影响。
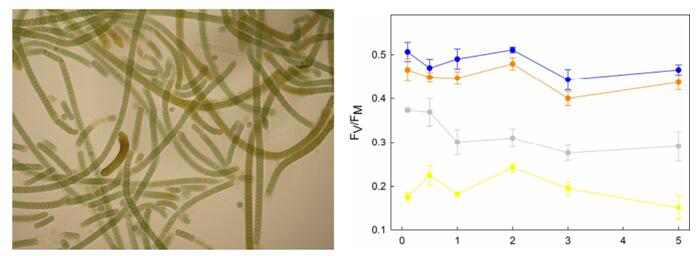
左:蓝藻Hassallia antarctica显微照片;右:不同浓度NaCl处理后Hassallia antarctica最大光化学效率Fv/Fm变化曲线
3. 生物膜侵蚀防治的研究
大理石雕像上经常会覆盖上绿色或黑灰色的生物膜。这种生物膜是蓝藻、藻类和真菌的混合体,并会逐渐侵蚀大理石。这对很多大理石文物造成了不可估量的损伤。为了对户外大理石雕像进行保护,欧洲尤其是意大利的相关科研机构开展了大量研究工作。
而为了评估生物膜的活性以及清洗后的效果,叶绿素荧光成像技术无疑是最为便捷、直接的技术。意大利弗洛伦萨应用物理研究所已经使用的FluorCam便携式叶绿素荧光成像仪进行了近十年的研究。早在2013年,他们就发表研究论文,介绍如何使用FluorCam便携式叶绿素荧光成像仪检测来自意大利佛罗伦萨的墓碑石片样品上的地衣。他们从测量得到的荧光参数中发现QYmax(即Fv/Fm)与这些地衣的生物活力有密切的相关性。而且与可见光图像相比,获得的荧光图像可以更加直接地表明地衣在岩石表面的活力分布并区分已死的和正常生长的地衣。

a)来自佛罗伦萨的墓碑样品;b)使用FluorCam便携式叶绿素荧光成像仪进行实验
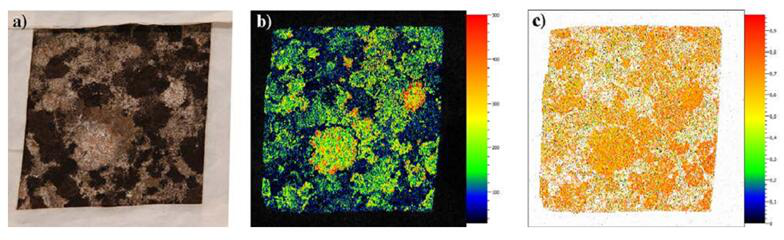
S2样品的成像图a)可见光成像b)叶绿素荧光Fm成像c)叶绿素荧光QYmax成像
在后续多年的研究中,他们一直在探索使用哪种清除技术,既能消除大理石上附着的生物膜,又不损伤大理石文物。在最近的研究中,他们使用523nm激光尝试清除大理石雕像上的生物膜。FluorCam便携式荧光成像仪为其检测清除效果并优化激光参数提供了最有力的数据。

左:通过叶绿素荧光成像图验证处理效果;右:工作中的FluorCam便携式荧光成像仪
4. 虫瘿光合特性研究
虫瘿是主要由昆虫诱导寄主植物细胞分裂加速而产生的一种异常组织,通常发生在叶片。一方面虫瘿破坏了寄主植物的源库关系,降低了虫瘿周围组织的光合能力,抑制了寄主植物的生长发育,导致花、果实、种子和生物量的产量降低。另一方面,虫瘿会产生过氧化氢等活性氧物质(ROS),对寄主植物造成高氧化胁迫,而寄主植物则能够通过产生酚类衍生物等次生代谢产物以减缓胁迫。对虫瘿光合能力进行直接测量并与叶片进行比较,能够使科学家更好的理解致瘿昆虫和寄主植物直接的关系。巴西乌贝兰迪亚联邦大学的Oliveira等人通过寄主植物Matayba guianensis—致瘿昆虫Bystracoccus mataybae互作体系,分析虫瘿组织光合活力和高氧化胁迫之间的平衡。为评估虫瘿组织的光合活性,使用了FluorCam便携式荧光成像系统,发现相比于非虫瘿组织,虫瘿组织最大光化学效率Fv/Fm较低(表征光合活性),光下实际光化学量子效率φPSII((Fm’–F’)/Fm’)与荧光衰减速率Rfd也较低,意味着其抵抗胁迫的能力也较差。结合气体交换光合参数和组化分析的结果表明:绿色的虫瘿具备一定的光合活性,但受到了虫瘿内幼虫的呼吸、取食行为引发的高氧化性胁迫的损伤。而寄主植物则通过原生质中酚类衍生物和用于形成畸形石细胞的木质素的累积,起到减缓胁迫的作用。

左:寄主植物Matayba guianensis及叶片上的虫瘿;右:带虫瘿叶片的叶绿素荧光成像
5. 国际空间站上的植物生理研究
美国航空航天局NASA一直在寻求一款可以在太空中直接测量植物生长状态和光合生理的仪器。仪器既要轻便小巧,又要功能强大,在不需要对样品进行太多处理的前提下就能获取大量科学数据。
FluorPen手持式叶绿素荧光仪最初就是应NASA这一要求开发的。在经过充分的地面测试和前期试验后,2017年4月,NASA的新一代先进植物培养器(Advanced Plant Habitat,APH)搭载联盟号MS-04货运飞船抵达国际空间站,而FluorPen手持式叶绿素荧光仪则作为配套检测仪器一起进入了太空。
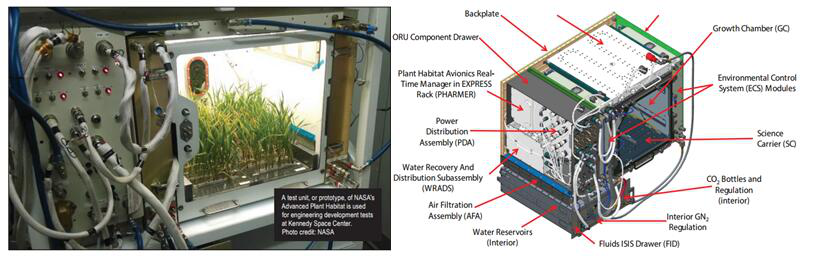
Advanced Plant Habitat设计图
宇航员按计划展开了植物生理学及太空新鲜食物种植( growth of fresh food in space)的研究。这不仅仅是为了研究植物在太空环境下生理活动的变化,更是希望能够在未来为宇航员长期太空生活提供食物。甚至在NASA的长期规划中,FluorPen还准备用于火星表面光合生命的检测以及探索地球植物在火星生活的可能性,为星际移民进行前期探索。同时,NASA也在探讨将更先进的FluorCam叶绿素荧光成像系统发射到国际空间站。

左:NASA肯尼迪航天中心的工程师使用FluorPen叶绿素荧光仪检测Advanced Plant Habitat中的拟南芥;右:FluorPen叶绿素荧光仪和Advanced Plant Habitat在国际空间站上的实际工作场景
参考文献
1. Šebela1D, et al. 2017. Chlorophyll fluorescence and reflectance-based non-invasive quantification of blast, bacterial blight and drought stresses in rice. Plant and Cell Physiology,59(1):30-43
2. Barták M, et al. 2009, Long-term study on vegetation responses to manipulated warming using open top chambers installed in three contrasting Antarctic habitats. Structure and function of antarctic terrestrial ecosystems, Masaryk University
3. Marečková M, et al. 2019. Temperature effects on photosynthetic performance of Antarctic lichen Dermatocarpon polyphyllizum: a chlorophyll fluorescence study. Polar Biology 42(4): 685–701
4. Mishra KB, et al. 2019. A correlative approach, combining chlorophyll a fluorescence, reflectance, and Raman spectroscopy, for monitoring hydration induced changes in Antarctic lichen Dermatocarpon polyphyllizum. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy 208: 13-23
5. Alonso MC, et al. 2018. Changes in chlorophyll fluorescence parameters during desiccation and osmotic stress of Hassallia antarctica culture. Czech Polar Reports 8 (2): 198-207
6. Osticioli, I. et al. 2013. Potential of chlorophyll fluorescence imaging for assessing bio–viability changes of biodeteriogen growths on stone monuments, Proc. SPIE 8790, Optics for Arts, Architecture, and Archaeology IV
7. Mascalchi M, et al. 2018. Laser removal of biofilm from Carrara marble using 532 nm: The first validation study. Measurement 130: 255-263
8. Oliveira D C, et al. 2017. Sink status and photosynthetic rate of the leaflet galls induced by Bystracoccus mataybae (Eriococcidae) on Matayba guianensis (Sapindaceae). Front. Plant Sci. 24
9. NASA Facts:Advanced Plant Habitat
